|
Дорогие друзья, меня зовут Берестов Михаил.
Я руководитель группы технической поддержки.
Очень часто Вы задаете по телефону вопросы про то
"как восстановить умерший аккумулятор?"
В этой статье я предлагаю Вам обсудить этот вопрос.
А если что-то будет неясно или тема будет не раскрыта,
пишите, пожалуйста, вопросы или звоните по телефону.
Так же мы подберем оборудование под ваши задачи
и расскажем Вам, как правильно устанавливать его!
|

Берестов Михаил |
Как восстановить аккумулятор?
Пожалуй, самым распространенным сегодня нестационарным источником питания является электрический аккумулятор. Ведь аккумуляторы бывают не только электрические, но и гидравлические, пневматические, механические (например, пружина механических часов).
Электроаккумуляторы обладают оптимальными характеристиками по сравнению с другими видами накопителей энергии - они легче и компактнее, без движущихся частей, дольше сохраняют энергию без потерь, у них достаточно высокий коэффициент полезного действия. Поэтому они нашли применение в различных электроприборах и аппаратуре.
Как основной источник питания аккумулятор применяется в портативных компьютерах, мобильных и радиотелефонах, фото- и видеокамерах; как резервный - в источниках бесперебойного питания, а также в большинстве устройств, обладающих CMOS-памятью. Это и BIOS твоего компьютера, и настройки каналов твоего телевизора и видеомагнитофона.
И даже в мобильном телефоне есть второй маленький аккумулятор, который сохраняет его настройки при снятой основной батарее. Но в процессе работы, особенно при неправильной эксплуатации, аккумулятор может потерять свои свойства. Как восстановить аккумулятор, мы расскажем в этой статье.
Принцип действия аккумулятора
Аккумулятор (от лат. accumulatio - накопление) - устройство накопления энергии для ее последующего использования. Электрический аккумулятор (дальше – просто «аккумулятор») накапливает энергию за счет обратимого химического процесса - преобразует при зарядке электрическую энергию в химическую, а затем по мере надобности отдает ее потребителю. Аккумуляторная батарея является набором последовательно соединенных аккумуляторов и может дополнительно снабжаться встроенными логическими элементами, термодатчиками и предохранителями, которые позволяют контролировать процесс зарядки.
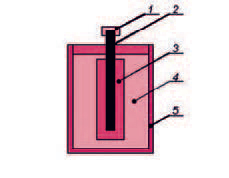
Основные принципы действия химических источников электрического тока были открыты еще в конце 18 века, и все современные аккумуляторы изготовлены на их основе, а конструкция с того времени практически не изменилась – появились лишь новые материалы и технологии, позволившие уменьшить размеры и повысить емкость батарей.
Если в электролит (растворы кислот, щелочей или солей, а также расплавы солей, в которых присутствуют свободные ионы - части молекул с положительным или отрицательным зарядом) погрузить два электрода из разных материалов (с разным химическим потенциалом), то на них начнется осаждение заряженных ионов. При этом на аноде - электроде с отрицательным химическим потенциалом (например, графитовом стержне) - будут осаждаться положительные ионы (катионы), и он станет положительным полюсом аккумулятора. Соответственно на втором электроде - катоде (например, цинковой банке) - осядут отрицательные ионы (анионы), и он станет отрицательным полюсом.
Этот электрохимический окислительно-восстановительный процесс назван «гальваническим» (в честь Луиджи Гальвани - итальянского ученого, открывшего возникновение разности потенциалов при контакте металла с электролитом). На этом принципе основана работа гальванических элементов питания - как одноразовых (элементов «первого рода», элементов Лекланше), так и перезаряжаемых (элементов «второго рода» - аккумуляторов), а также топливных элементов, в которых электролит для реакции подается непрерывно.
Перезарядка
Перезарядка аккумуляторов возможна за счет обратимости химических процессов при пропускании электрического тока. При этом происходит процесс восстановления материала электродов и насыщение электролита (возврат осевших на электродах ионов в раствор). Так как химические процессы окисления-восстановления являются достаточно медленными и сопровождаются выделением тепла (аккумуляторы при зарядке и быстрой разрядке греются, кислотные могут закипеть, а литиевые - даже взорваться), то зарядка является достаточно длительным процессом (8-16 часов). Естественно, и отдать энергию сразу аккумуляторы не способны.
В этом их отличие от конденсаторов, которые не являются гальваническими элементами - они только накапливают заряд на поверхности обкладок, намного меньший, чем может хранить электролит в том же объеме, но зато могут и отдать весь заряд практически мгновенно.
Виды аккумуляторов
Наиболее распространенными аккумуляторами являются кислотные (например, автомобильные) и «сухие» (для портативных компьютеров, сотовых телефонов и т.п.), где электролит либо загерметизирован или связан твердым материалом, либо находится в гелеобразном состоянии. Среди бытовых аккумуляторных элементов сегодня наиболее распространены три вида: никель-кадмиевые (Ni-Cd), никель-металлогидридные (Ni-MH) и литий-ионные (Li-Ion).

Никель-кадмиевые аккумуляторы имеют никелевый анод и кадмиевый катод, рабочее напряжение 1.2 В. Несмотря на невысокую емкость Ni-Cd элементов (порядка 0.5-1 Ач для элементов формата АА – «пальчиковые батарейки»), они имеют свои преимущества. Они обладают низким внутренним сопротивлением, потому способны подавать на выход достаточно сильный ток без падения напряжения до полной разрядки, обеспечивают большое число циклов зарядки/разрядки (500-1000).
Но применение кадмия в процессе электролиза вызывает выделение водорода, который может привести к взрыву. Для предотвращения разрушения корпуса аккумулятора в нем делают вентиляционные отверстия, через которые выходят излишки водорода. По этой причине нельзя герметично закрывать эти элементы, а корпуса батарей необходимо делать с отверстиями. Кроме того, кадмий является токсичным веществом, и должен быть переработан после утилизации.
Никель-кадмиевые аккумуляторы характеризуются саморазрядом в пределах 10% в первые сутки после зарядки и примерно по 10% каждый месяц. Саморазряд является следствием химической реакции, протекающей в аккумуляторе даже при отсутствии нагрузки.
Эффект «памяти» аккумуляторов
Основная проблема Ni-Cd аккумуляторов - это эффект «памяти» уровня заряда: если такой элемент разрядить не полностью, то на аноде образуются кристаллы кадмия, уменьшающие полезную емкость батареи. При достижении того же «неполного» уровня при следующей разрядке напряжение упадет точно так же, как если бы аккумулятор был полностью разряжен. Для восстановления первоначальной емкости необходимо проводить «раскачивание», циклы «полная зарядка - полная разрядка».
Причем, так как электронные приборы при падении напряжения, просто отключаются, то для «глубокой» разрядки необходимо наличие электрического потребителя, не отключающегося при падении напряжения (например, электрическая лампочка или реостат).

Причина «памяти» Ni-Cd аккумуляторов - материал катода. Для катода идеальным материалом является водород, но при комнатной температуре и атмосферном давлении он находится в газообразном состоянии. Зато есть металлы, позволяющие связывать в своей структуре атомарный водород в объеме в 1000 раз превышающем их собственный. Это цинк, никель и литий, чьи соединения с водородом получили название «гидриды».
Соответственно, у Ni-MH аккумуляторов никелевый анод и никель-гидридный катод. Такие аккумуляторы практически не обладают памятью, являются экологически чистыми (за счет отсутствия токсичных металлов), обладают большей емкостью (в 1,5-2 раза больше, чем у Ni-Cd), также могут выдерживать ток большой силы. Но у Ni-MH аккумуляторов есть и существенные недостатки по сравнению с Ni-Cd. Ni-MH более подвержены саморазрядке: при зарядке до 1.4 В напряжение падает до 1.2 В в первые часы, а иногда и минуты, затем оно держится постоянным до полной разрядки.
При этом аккумулятор теряет по 3-5% заряда в сутки (80-100% в месяц), соответственно при хранении их необходимо ежемесячно подзаряжать. Кроме того, Ni-MH аккумуляторы при зарядке сильно нагреваются, потому для них необходимо наличие специальных зарядных устройств с контролем температуры.
Li-Ion
Следующим химически активным веществом после водорода в таблице Менделеева является литий (гелий, следующий за водородом - инертный газ, не обладающий химическим потенциалом). Это самый активный металл, и самые компактные аккумуляторы изготавливаются именно с литиевыми катодами. Литий настолько активен, что может самовозгораться на воздухе, потому в аккумуляторах он находится в ионном виде, связанном молекулами оксидов металлов. Li-Ion аккумулятор состоит из угольного анода, литий-кобальт-диоксидного катода и жидкого электролита, которым пропитан слой нетканого синтетического материала.
Такие аккумуляторы не имеют «памяти», обладают в 1.5-2 раза большей емкостью, чем Ni-MH, напряжением выше 1.5 В (обычно 3.6), но у них тоже есть свои недостатки. Li-Ion аккумуляторы не могут выдавать ток большой силы из-за высокого внутреннего сопротивления. Соответственно, их применение целесообразно в устройствах с длительным потреблением тока без резких перепадов мощности (телефоны, часы, фотокамеры, ноутбуки). Они не встречаются в формате АА, так как из-за активных свойств лития необходимо контролировать процесс зарядки электронной схемой, которую не так просто разместить в столь небольшом элементе.
Борьба за емкость
Помимо повышения емкости аккумуляторов за счет применения новых веществ, можно повысить удельную емкость за счет более рационального использования пространства: батареи с элементами прямоугольной или плоской формы позволяют повысить емкость на 20% по сравнению с батареями из цилиндрических элементов. В таких «нестандартных» элементах вместо жидкого электролита применяется полимер (например, такой композитный материал, как полиакрилонитрит), который содержит литиевую соль. Соответственно, такие элементы не нуждаются в надежной герметичной защитной оболочке, за счет чего снижается их масса и повышается удельный заряд.

Но и у литий-ионных аккумуляторов еще не исчерпан ресурс емкости. Специалистам из Sandia National Laboratories удалось повысить емкость аккумуляторных батарей в 10 раз за счет применения кремний-углеродного анода. Но они столкнулись с проблемой снижения емкости при каждой последующей зарядке, связанной с разрушением анода под воздействием большого тока.
Замедлить разрушение анода и уменьшение емкости удалось за счет применения композитных материалов, более устойчивых к действию большого тока. Пока такие аккумуляторы находятся в стадии разработки, и их массовый выпуск ожидается в том случае, если удастся замедлить снижение емкости до приемлемого уровня.
Характеристики аккумуляторов
Электрическими параметрами аккумуляторов являются напряжение, емкость, ток зарядки/разрядки, внутреннее сопротивление.
Напряжение - это разность электрических потенциалов катода и анода, которая возникает в ходе химической реакции. Оно зависит, прежде всего, от химического потенциала электродов. Для большинства свинцово-кислотных аккумуляторных элементов это напряжение составляет 2 В, для никелевых - 1.2 В, для литиевых - 3.6 вольт. Для получения заданного напряжения эти элементы последовательно соединяют в аккумуляторные батареи. Например, в автомобиле для получения 12 вольт требуется 6 свинцово-кислотных элементов, а для 3.6 В в мобильном телефоне - 3 никелевых или один литиевый. Для наращивания же емкости элементы соединяются параллельно. Например, в батарее ноутбуков IBM часто применяются 3 последовательно соединенных блока, в каждом из которых запаралелены по две пары последовательно соединенных аккумуляторов.
Емкость батареи - это ее максимальный заряд, или то время, которое полностью заряженная батарея сможет непрерывно давать заданный ток:
C = q [Кл] = I*t [A*c], где q - заряд, I - сила тока, t - время.
Для удобства время указывают не в секундах (как принято в системе Си), а в часах:
C = I*t [А*ч], что равно 3600q [Кл].
Это значит, что вместо маркировки 5400 А*с мы обычно видим более удобное и привычное обозначение 1.5 А*ч.
Характеристикой типа аккумулятора является удельная емкость - мощность единицы массы элемента [Вт*ч/кг]. Для Ni-Cd элементов эта величина составляет 40-80, для Ni-MH - 60-80, для Li-Ion - 90-110, для Li-полимерных - 130-150 Вт*ч/кг.
Максимальный ток
Еще один немаловажный рабочий параметр аккумулятора - это максимальный ток. Если ток разрядки - это только ограничение эксплуатационных возможностей, то ток зарядки - это ограничение, превышение которого выведет аккумулятор из строя. В электронных устройствах этот ток обычно существенно ниже максимального, чтобы увеличить срок службы батареи. В некоторых устройствах отсутствует контроллер зарядки, и аккумуляторы постоянно находятся в режиме подзарядки малым током.
Со временем этого тока уже не хватает для достижения полного заряда - происходит отложение продуктов реакции на электродах, и для процесса восстановления необходим больший ток. Часто «оживить» незаряжающиеся аккумуляторы получалось кратковременной подачей тока в 2 раза большей силы при напряжении порядка 1.5 В, после чего зарядка проводилась с номинальными параметрами.
Сила тока разрядки обычно ограничивается производителем и находится в пределах 0.2-0.5 от величины емкости элемента. Сила тока зарядки определяется по правилу:
I(зар) = k*C(бат) [А], где С (бат) - емкость батареи [А*ч], k - коэффициент, зависящий от типа батареи.
Для Ni-Cd можно принять k = 0.2, для Ni-MH это значение ниже: k = 0.1. Рекомендуемое время зарядки для Ni-Cd элементов - 6-8 часов, для Ni-MH - 14-16 часов.
Алгоритм восстановления Ni-MH аккумуляторов
Как было сказано выше, потеря емкости аккумулятора связана с отложением продуктов реакции на электродах. Для восстановления аккумулятора необходимо вернуть эти продукты в исходное состояние.
Для этого необходимо иметь в наличии следующее:
- источник питания с плавной регулировкой напряжения, индикаторами силы тока и напряжения (можно также воспользоваться отдельными вольтметром и амперметром);
- подготовленные для зарядки аккумуляторные элементы;
- нагрузку - реостат или лампочку, сопротивление которых необходимо подобрать исходя из формулы:
R = U / I [Ом], где U - номинальное напряжение батареи [B], I - необходимая сила тока [A], которая берется из расчета I = 0.4 С (бат).
Желательно также иметь в наличии термодатчик или термореле, чтобы можно было вовремя отключить ток при перегреве.
Перед зарядкой разрядим аккумулятор до напряжения порядка 1 В - подключаем вольтметр и нагрузку параллельно элементу. Периодически контролируем напряжение (оно не должно упасть ниже 0.9 В - могут начаться необратимые процессы). Периодически контролируем температуру - она не должна подниматься выше 50 градусов Цельсия. В противном случае необходимо отключать нагрузку до тех пор, пока элемент не остынет до комнатной температуры. После разрядки необходимо выждать время для нормализации процессов внутри элемента (15-20 минут). За это время элемент «регенерируется», напряжение повысится, и его можно доразрядить до напряжения 0.9 В. Далее, выждав 10-15 минут, можно приступать к зарядке.
Зарядка
Для зарядки подсоединяем амперметр последовательно к заряжаемому элементу, источник питания и вольтметр - параллельно, одним контактом к свободному полюсу аккумулятора, другим - к свободному контакту амперметра. Термодатчик или чувствительный элемент, термореле, желательно закрепить на аккумуляторе с использованием термопасты для более точных измерений. Устанавливаем регулятор напряжения источника питания на минимальное напряжение (реостат - на максимальное сопротивление). Далее - плавно поднимаем напряжение так, чтобы сила тока на амперметре достигла значения:
I(зар) = 0.1C(бат)
Например, для аккумулятора емкостью 1500 мАч максимальная сила тока будет 150 мА. Сила тока будет постепенно снижаться, и соответственно, необходимо повышать напряжение. Сначала - раз в 3-5 минут в течение первого часа, далее - каждый час. Как только напряжение достигнет 1.3 номинального (1.4-1.5 вольт), нужно оставить аккумулятор на зарядке как есть - далее повышать напряжение нельзя. Когда сила тока упадет до значения близкого к нулю (через 4-6 часов), нужно отключить зарядку, подождать 15-20 минут для нормализации процессов, и поставить заряжаться на 8 часов.
На всем протяжении зарядки необходимо следить за тем, чтобы температура не поднималась выше 50 градусов Цельсия. Если же температура превышает это значение - надо понизить ток зарядки (в 1.5-2 раза) до тех пор, пока аккумулятор не остынет до 30 градусов. Затем можно плавно поднять ток до номинального значения. Для восстановления первоначальной емкости потребуется 3-4 таких цикла.
В случае с мобильными телефонами можно действовать аналогично средствами самого телефона:
- полная разрядка телефона до отключения;
- ожидание регенерации (10-15 минут);
- повторное включение до полной разрядки;
- постановка на зарядку до полного заряда (отключение индикатора зарядки, сообщение «зарядка завершена»);
- отключение зарядки (2-5 минут);
- повторное включение на зарядку на 8 часов.
Необходимо произвести порядка трех таких циклов, причем рекомендуется производить эти операции как сразу после приобретения нового аппарата или новой батареи, так и через каждые 3-6 месяцев эксплуатации.
Tips & Tricks
1. Чтобы разобрать склеенный аккумуляторный блок, можно использовать отвертку с пластиковой ручкой и короткий скругленный нож. Ручкой отвертки обстукиваем корпус батареи по шву, затем в щель вставляем нож, и, создавая небольшое усилие его наклоном, продолжаем обстукивать батарею. Корпус начнет расходиться, и нож нужно будет передвигать дальше, до полной разборки батареи. Конечно, не все батареи разбираются легко, есть риск повредить тонкий корпус, но при достаточной тренировке можно будет разбирать практически любые клееные корпуса быстро и без повреждений, а затем склеивать их обратно.
2. Для восстановления аккумулятора может понадобиться замена элементов. Необходимо приобрести элементы не только такого же типа (Ni-Cd или Ni-MH) и размера, но и желательно не превышать номинальной емкости «родных» элементов - в противном случае ток зарядки может быть выше, или будет некорректно срабатывать логическая схема контроллера зарядки, что вызовет ошибочное отображение заряда аккумуляторов и несвоевременное отключение зарядного устройства.
Перед расстыковкой элементов рекомендуем зарисовать схему расположения и соединения элементов с указанием полярности. Затем ножом срезать соединительные пластинки. При сборке новых элементов нельзя допустить перегрева, поэтому соединительные пластинки надо пропаять в первую очередь. Желательно, изготовить новые из медной фольги. Места контакта аккумуляторных элементов сначала зачищаются от окисной пленки, затем на эти точки помещается капля паяльной кислоты. Лужение производится быстрым (на полсекунды) касанием паяльника с оловом. Затем соединительные пластинки накладываются пропаянной стороной на пропаянные площадки аккумуляторов и прижимаются паяльником на 1-2 секунды (до момента плавления олова), затем нужно быстро остудить элементы. По завершении пайки нужно проверить правильность соединения элементов и померить напряжение батареи. Если все сделано корректно, то на контактах будет соблюдена полярность, а напряжение будет в пределах 0.8-1.0 номинала батареи.
3. Хранение аккумуляторов. Аккумуляторы нужно хранить полностью ЗАРЯЖЕННЫМИ! При хранении надо регулярно (раз в 1-2 месяца) проверять напряжение. Оно не должно падать ниже 1 В. Если же напряжение упало, необходимо зарядить аккумуляторы заново. Единственные аккумуляторы, которые могут храниться разряженными - это Ni-Cd.
Саморазряд батарей происходит из-за той же химической реакции электродов и электролита, которая происходит в процессе работы (разрядки под нагрузкой), только без нагрузки эти процессы протекают существенно медленнее. Причем, при снижении температуры эти процессы замедляются, соответственно для снижения саморазряда хранить аккумуляторы надо в прохладном сухом месте. Для этих целей вполне подходит холодильник. Но нельзя помещать аккумуляторы в морозильную камеру - начнет конденсироваться влага, являющаяся причиной коррозии и утечки тока. А из-за резкого перепада температуры может расслоиться электролит. Оптимальная температура хранения - 1-5 градусов Цельсия.
Зачем обжимают «севшие» батарейки
Если обжать корпус севшей батарейки, то устранятся полости между электродами и электролитом, возникшие в процессе реакции. Сам электролит распределится более равномерно. Увеличится скорость реакции и восстановится ток. Таким образом, батарейка протянет еще некоторое время. Главное – не перестараться и не замкнуть электроды :).
Полезная информация для автовладельцев. Зимой, при сильном морозе, процессы в аккумуляторе замедляются настолько, что силы тока даже полностью заряженного аккумулятора не хватает для раскрутки стартера. Конечно, это также связано с загустеванием масла, поэтому для облегчения запуска двигателя обычно сразу после выключения двигателя добавляют немного бензина в картер и делают 5-10 оборотов коленвала стартером (без запуска двигателя), а запускают двигатель с выжатым сцеплением. Но повысить ток аккумулятора можно за счет нагрева, который можно произвести включением на 10-15 минут ламп ближнего света.
Под действием потребителя электроэнергии аккумулятор разогревается, увеличивается скорость химической реакции, растет ток (что можно увидеть по повышению яркости свечения фар). Этого тока вполне хватит для запуска двигателя. И еще: лучше дольше непрерывно «крутить стартер», чем пытаться запустить двигатель короткими включениями. Каждое включение сопровождается резким повышением тока, который падает по мере раскрутки стартера, и чем меньше таких включений, тем дольше проработает стартер от аккумулятора, и тем выше будет вероятность успешного запуска.

Согласно Правилам, которые регламентируют пожарную безопасность в Российской Федерации, помещения, где одновременно располагается более полусотни людей, называют местами массового пребывания.
|

На хищение чужого имущества, в том числе квартирные кражи, приходится почти половина преступлений, совершаемых в стране. В статье описано как обезопасить свою собственность от воров и где ни в коем случае нельзя прятать заначку.
|
|
|